由新冠病毒(SARS-CoV-2)引起的新冠病毒肺炎(COVID-19)是一种全球流行性传染病,其刺突蛋白S1/S2边界的多碱基弗林蛋白酶(Furin)切割位点是SARS-CoV-2的标志,在病毒感染中起着至关重要的作用。然而,Furin活化及其调控的机制仍然知之甚少。
2024年5月16日,中山大学药学院毛洋教授、袁燕秋副教授联合广州医科大学附属第一医院赵金存教授团队在“Nature Communications,IF 16.6”在线发表题为Sequential glycosylations at the multibasic cleavage site of SARS-CoV-2 spike protein regulate viral activity的论文,研究结果强调了糖基化作为宿主细胞对抗SARS-CoV-2的防御机制的作用,并揭示了宿主与病毒之间的进化相互作用,为开发针对SARS-CoV-2的潜在治疗干预策略奠定了理论基础。

研究结果
1、GalNAc-T3和T7抑制刺突蛋白的Furin加工
首先,作者分析了新冠病毒刺突蛋白的O-糖基化修饰,发现T678、S686和S689可能是Furin酶附近的潜在糖基化位点,进一步通过体外糖基化反应发现糖基转移酶GalNAc-T3与T7活性可能与重组刺突蛋白上鉴定的O-糖基化位点(T678、S686和S689)有关。接下来,为确定GalNAc-T3和T7引发的O-糖基化是否能抑制细胞中S蛋白多碱基切割位点的蛋白酶加工,作者构建了一个包含刺突多碱基切割位点蛋白酶加工活性的荧光素酶生物传感器。结合体外酶活性测定,生物传感器实验结果表明,GalNAc-T3和T7在SARS-CoV-2 S蛋白多碱基切割位点上的串联糖基化修饰能够抑制细胞内Furin的切割。在合胞体形成测定实验中,T7在S686位点的糖基化在阻止细胞蛋白酶的蛋白质加工和抑制其融合活性方面起着关键作用,这些发现对SARS-CoV-2刺突蛋白的激活具有潜在的意义。
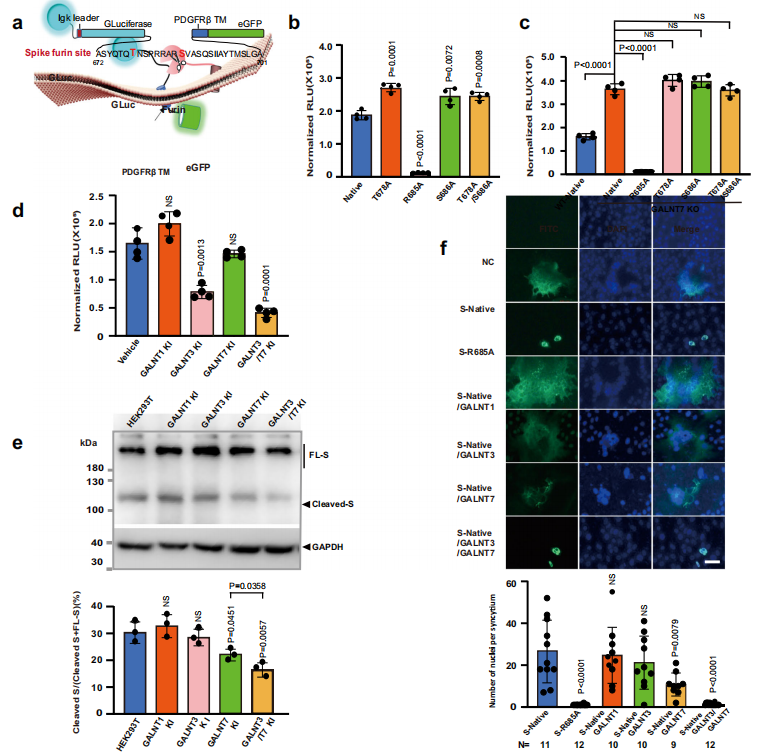
图1. GalNAc-T3和T7通过在T678和S686位点特异性糖基化抑制Furin对S蛋白的加工
2、GalNAc-T3和T7抑制Furin依赖的病毒样颗粒的组装
由于参与O-糖基化途径的大多数酶位于高尔基体中,冠状病毒在ER-高尔基中间室(ERGIC)中组装,因此作者探究了GalNAc-T3和T7糖基化活性对组装的病毒样颗粒中刺突蛋白Furin切割的潜在影响。在具有或不具有GALNT3和/或GALNT7 KI的HEK293T细胞中组装SARS-CoV-2的病毒样颗粒(VLPs),发现GALNT3和GALNT7的双KI导致包装在VLP颗粒中的刺突蛋白数量减少了大约80%,而刺突蛋白在总细胞裂解物中的表达水平没有明显变化。相比之下,GALNT3的单个KI或普遍表达的GALNT1并不显著影响刺突蛋白在VLP中的组装,而GALNT7的单个KI也显著降低刺突蛋白的结合量( 53 % )。尽管在细胞裂解液中存在大量未裂解的刺突蛋白,但整合到VLPs中的刺突蛋白主要被裂解。这一发现表明裂解的刺突蛋白可以更有效地整合到VLP中,Furin加工有助于刺突蛋白组装到SARS-CoV-2的VLP中。进一步研究发现GalNAc-T3和T7可能通过T678和S686的糖基化抑制刺突蛋白并入VLP。接下来,作者研究了Furin切割依赖的刺突蛋白组装到SARS CoV-2病毒粒子中的可能机制,发现SARS-CoV-2的M蛋白通过其EE基序与Furin切割时暴露的S1片段富含精氨酸的C端之间的电荷相互作用与裂解的S蛋白特异性相互作用,这种相互作用对于含有刺突蛋白的功能性病毒粒子的组装是必不可少的。综上,宿主细胞中表达的GalNAc-T3和T7对Furin切割的调控可能对病毒粒子组装产生重大影响,从而影响SARS-CoV-2引起的感染。
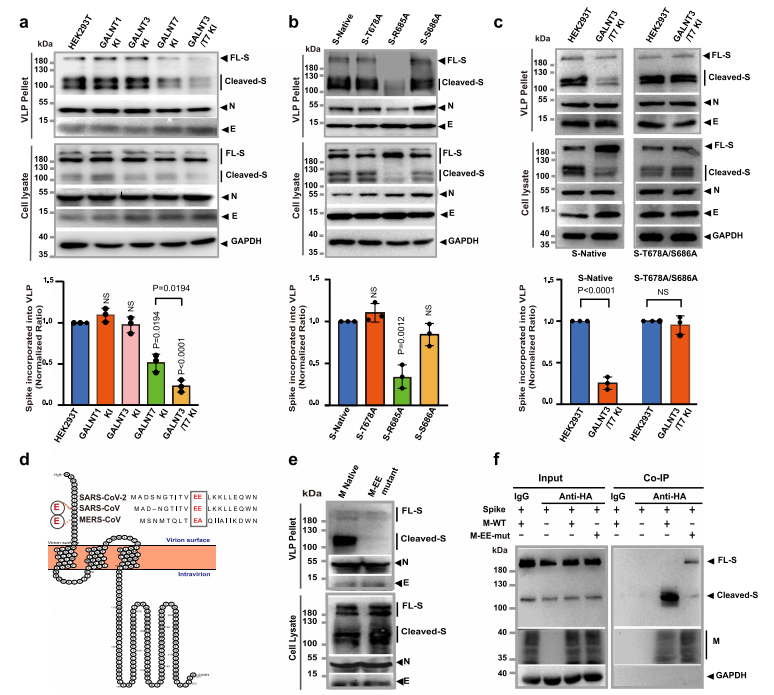
图2. GalNAc-T3和T7抑制Furin依赖的病毒样颗粒的组装
3、多碱基切割位点附近的突变改变了GalNAc-T3和T7的糖基化效率
在WHO划分的5种关切变异株(VOC)中,有3种在脯氨酸681 (P681)处携带突变,距离糖基化位点T678有3个氨基酸。其中,α和Omicron变体在该位置有一个组氨酸(P681H),而δ变体在该位置有一个精氨酸(P681R)。此外,Omicron变体在O-糖基化位点T678旁边携带N679K突变。作者推测P681突变可能在体外影响GalNAc-T3和T7对S蛋白的酶活性。进一步实验发现将合成肽底物中的P681残基与组氨酸(P681H)交换时,GalNAc-T3和T7不能有效地将肽糖基化;当P681H突变与发生在Omicron中的N679K突变叠加时,GalNAc-T3和T7在酶促实验中对合成肽恢复了显著的活性,产生了单/双GalNAc修饰产物。以上结果表明SARS-CoV-2变异体在多碱基切割位点附近携带的突变对GalNAc-T3和T7的糖基化效率有显著影响,SARS-CoV-2的早期变体(α和δ)携带的P681突变可能使病毒能够抵抗宿主细胞糖基化,但在Omicron变体中引入额外的N679K突变可能使病毒再次对宿主细胞糖基化的调节敏感。
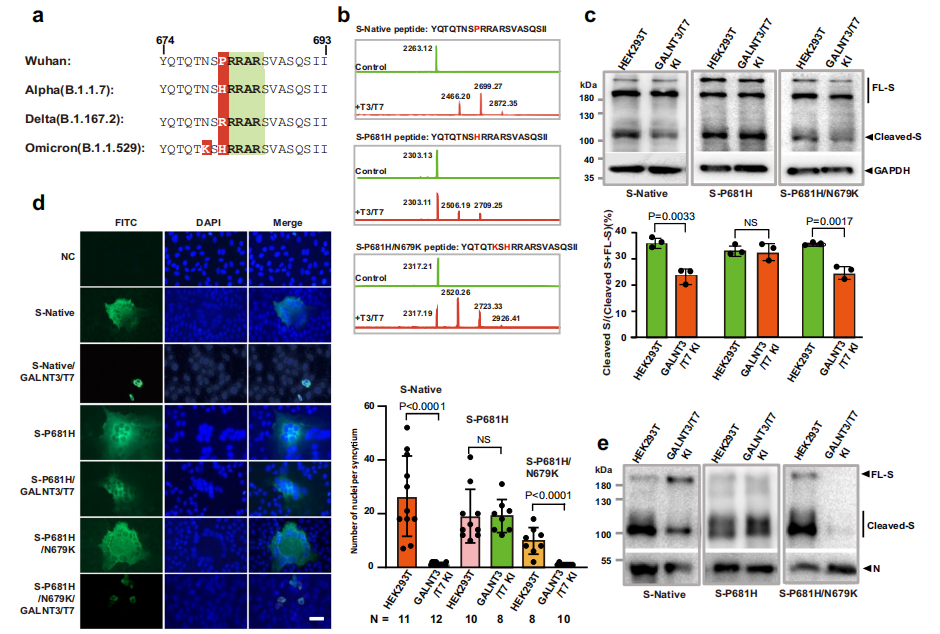
图3. 多碱基切割位点附近的突变改变了GalNAc-T3和T7的糖基化效率
4、在人肺细胞中过表达GalNAc-T3和T7抑制Omicron复制
作者进一步探究了SARS-CoV-2的Omicron变异株对GalNAc-T3和GalNAc-T7在人肺细胞中的抑制作用的敏感性。为评估GalNAc-Ts对病毒复制的影响,作者用早期Omicron亚变体BA.1、原始的Wuhan-Hu1和α亚变体B1.1.7感染了人肺细胞系Calu-3细胞,并测定了GalNAc-T3和T7单独或联合过表达或不过表达的病毒滴度。在前24小时内,GalNAc-T3和T7的共表达在MOI为0.1时,显著抑制了BA.1的复制;感染后48小时,与野生型细胞(WT)相比,过表达GalNAc-T3和T7的Calu-3细胞中Omicron的病毒滴度降低了约76%。值得注意的是,单独表达GalNAc-T7也表现出类似程度的病毒滴度降低。这一发现与GalNAc-T7在抑制刺突蛋白组装成病毒样颗粒(VLP)中的突出作用是一致的。收集Omicron病毒颗粒,并通过western blot分析了S和N蛋白的水平,发现GalNAc-T3和T7共同过表达以及GalNAc-T7的单独过表达均导致结合到Omicron病毒粒子中的S蛋白显著减少,反映了GalNAc-T3和T7抑制S蛋白组装成VLP。结合体外糖基化研究,这些结果强烈提示,GalNAc-T3和T7对Omicron病毒的抑制可能是通过在刺突蛋白的Furin加工位点进行糖基化来实现的。以上表明GalNAc-T3和T7介导的糖基化在病毒感染的调节中发挥重要作用,目前流行的SARS-CoV-2变体Omicron仍然对这种调节有反应,提示刺突蛋白多碱基位点的糖基化可用于未来的治疗干预。
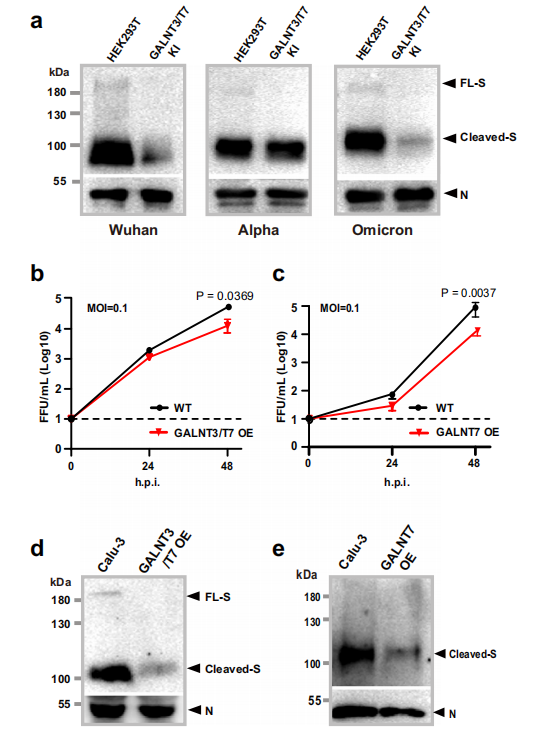
图4. 在人肺细胞中过表达GalNAc-T3和T7抑制Omicron复制
结论
本研究发现GalNAc-T3和T7共同启动SARS-CoV-2刺突蛋白Furin切割位点的O-糖基化,从而抑制Furin加工,进而抑制刺突蛋白与病毒样颗粒的结合,并影响病毒感染。SARS-CoV-2病毒的α和δ变体的刺突蛋白的突变使病毒对GalNAc-T3和T7的糖基化产生抗性。在Omicron突变体中,额外的突变逆转了这种抗性,使得刺突蛋白在体外对糖基化敏感,并对人肺细胞中GalNAc-T3和T7的表达敏感。研究结果强调了糖基化作为宿主细胞对抗SARS-CoV-2的防御机制的作用,并揭示了宿主与病毒之间的进化相互作用。
