不少临床研究或临床试验的结果显示,间充质干细胞(MSC)能治疗多种疾病,尤其是一些疑难杂症,但是疗效各有差异,甚至治疗无效的案例也属常见。面对不断积累的失败的临床治疗案例,研究者开始冷静反思:具有治疗功能的间充质干细胞为何会临床治疗无效?对于这个问题,不同的研究者有不同的思考和解释。本笔者也试图从多方面去解开这个谜团,具体参见本公众号的文章具有免疫抑制能力的MSC为何败在治疗GVHD的3期临床试验?。
本文主要从间充质干细胞输入人体后的分布和代谢方面给于阐述。首先,应该意识到间充质干细胞(MSC)和化学药物具有明显的差异:包括但不限于①化学药物是死的,而MSC是有生命的;②化学药物有明确的半衰期,MSC暂时没发现;③化学药物有明确的单一靶位点,MSC通过多途径发挥作用;④化学药物在体内都是被动运输,MSC具有主动趋化迁移的功能特性;⑤化学药物的均一性非常好,MSC的均一性很差,细胞周期的步伐并不十分一致。这些差异给临床治疗带来什么样的思考?在临床研究或应用上,研究者习惯性基于化学药物的思维来对待细胞是否合适?
大量的实验数据证明间充质干细胞输入体内后,并没有长期停留在体内,而且随着时间的延长而被机体清除。这也解释了间充质干细胞的作用机制不在于分化为组织特异性的成熟细胞。动物实验显示:免疫系统健全的机体,其清除输入体内MSC的速率越快;免疫缺陷的机体,其清除输入体内MSC的速度越慢。输入体内MSC的清除还与输入途径有密切关系,组织局部注射、外周静脉注射、动脉注射,均对MSC在体内的存留时间产生较大的影响。下面的内容将给予详细论述。
1,局部注射输入
常见局部注射MSC的部位有脑部、四肢肌肉、心脏、肝脏、腰椎(蛛网膜下腔)。
局部微注射人骨髓MSC到大鼠大脑纹状体部位,72天后,依然能检测到人骨髓MSC的存在,而且MSC能迁移至胼胝体和大脑皮层[1]。大脑右侧尾状核局部注射MSC,4周后大脑多个部位均可以检测MSC的存在,而且发现MSC在大脑的迁移,偏好于沿着血管的走向[2]。但是MSC颈动脉注射后,在脑部的存活时间一般都是1-2天[3-5]。氧化铁标记的骨髓MSC颈动脉注射治疗大脑中动脉栓塞模型(MCAO)大鼠,24小时后,核磁共振成像(MRI)显示MSC能穿过血脑屏障,迁移到大脑皮层、皮质下白质层、纹状体、脑干部位,甚至观察到MSC能迁移到对侧大脑[4]。分别给大鼠颈动脉注射人骨髓MSC和大鼠骨髓MSC,发现人骨髓MSC的清除快于大鼠骨髓MSC,这说明机体清除异种属的细胞的速率更快[3]。
TNF-α和IL-1β先刺激MSC(24小时),MSC再心室内局部注射;和对照组相比,经过TNF-α和IL-1β刺激的MSC趋化迁移到心肌缺血区域的细胞数量明显增多,证明了TNF-α和IL-1β可以增强MSC的粘附能力,但是这种作用可以被VCAM-1的单克隆抗体所阻断[6]。
2,全身性注射输入
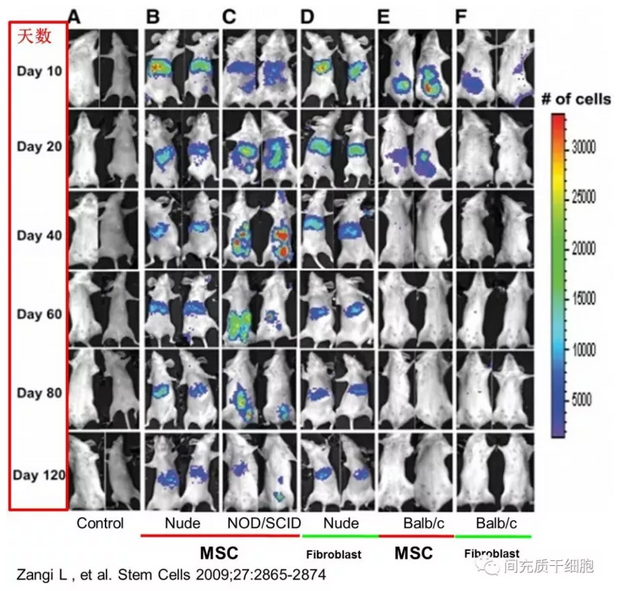
MSC腹腔注射免疫缺陷的小鼠(裸鼠和NOD/SCID小鼠)后,在体内多组织器官中存在可达120天,而MSC在免疫系统健全的异品种小鼠只能存在20多天,但是可以在同品种小鼠中存在40多天(见图)[7]。
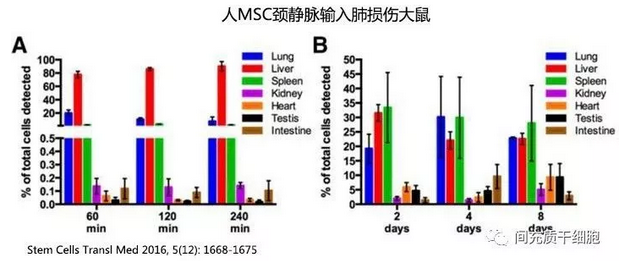
人MSC从大鼠颈静脉输入1小时后,大鼠体内检测到的人MSC下降到82%左右,8天后只能检测0.06%;大部分在肺部、肝脏和脾脏,但也有少数MSC出现在肾脏、小肠和睾丸,而且随着时间的推移(2天到8天),睾丸中MSC的含量略有增多(4.6%到9.3%,黑色柱子)(见下图,注意图中的百分比是指体内能检测到的细胞数,不是指输入的细胞总数)[8]。
狒狒实验证明骨髓MSC经外周静脉输入体内后,自体MSC和异体MSC在体内的分布没有明显的差异[9]。脐血来源的MSC比骨髓MSC容易通过肺脏,而且年龄越大的供体,其骨髓MSC越容易在肺部滞留;在肺部滞留的MSC细胞数量,与MSC细胞表面表达的整合素α4和α6密切相关,表达量越高,越不容易在肺部滞留[10]。
外周静脉输入MSC后,大部分的MSC滞留在肺部[10-16],然后随着血流达到肝脏、肾脏、脾脏[17]。虽然全肺均有MSC分布[11],有研究显示右肺聚集MSC的数量多于左肺[17],也有研究显示MSC在左肺聚集多于右肺[18]。
MSC注射1小时后,50-60%的MSC滞留在肺部[13, 14],3个小时后降至30%,并维持到96小时[13]。有肺损伤同时存在时,MSC在肺部的滞留增多[8],甚至可高达83%[15]。虽然外周静脉输入的MSC大部分在肺部滞留并被清除,但是MSC可以被肺部局部的微环境所激活,分泌大量的抗炎因子TSG-6,有利于减轻炎症和减少心梗缺血区的面积[15]。
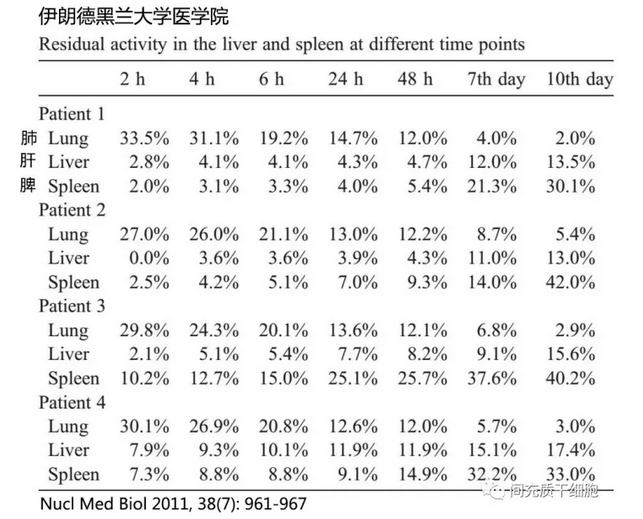
失代偿期肝硬化患者自体骨髓MSC体外扩增后,外周静脉输入用111In-oxine(放射性示踪元素)标记MSC,在不同时间点检测这些标记的MSC,结果发现随着时间的延长,肺部滞留的MSC逐渐减少,而在肝脏和脾脏逐渐增多,而且MSC在脾脏聚集的细胞数多于肝脏(见下图)[19]。
早已经证明了外周静脉输入MSC能少量迁移到四肢骨髓定植[16, 20-22],但是给与血管舒张剂处理,迁移到骨髓中的MSC增加了50%的细胞数[12]。迁移至骨髓的MSC,在骨髓中存在的最长时间为76天[22]。但是体外培养超过12代后的MSC,以及年龄大的供体来源的MSC,它们迁移到骨髓的明显能力下降[16];对骨髓进行照射损伤后,迁移至损伤骨髓的MSC数量增多[16]。静脉输入的MSC亦可以迁移到脊髓中[18],这为外周静脉输入MSC治疗脊髓损伤提供了实验基础。
3,不同途径的比较
建立猪的心肌梗塞疾病模型,通过3种不同的途径(外周静脉、冠状动脉注射、心内膜注射)输入骨髓MSC,14天后检测心肌梗塞部位的MSC的细胞数,结果发现冠状动脉注射MSC的治疗效果最好,迁移到缺血区域的MSC细胞数最多,然后依次是心内膜注射,缺血局部检测不到外周静脉注射的MSC;但是,即使是局部注射MSC,大约10%的MSC还是会进入循环系统而迁移到肺和肝脏[23]。
建立骨关节炎(osteoarthritis)和关节炎(arthritis)小鼠模型,给与尾静脉注射人脂肪MSC(脂肪干细胞),10天后在小鼠体内已经检测不到人脂肪MSC;但是给与关节腔局部注射人脂肪MSC,依然在10天后可以检测到人MSC的存在;这数据说明了全身性静脉输入MSC在体内的清除速度快于局部注射[24]。
大鼠颈外动脉注射MSC,于10天后依然可以在大脑皮质层找到MSC,而且通过血脑屏障的MSC还能迁移到对侧大脑,但是大脑中却检测不到外周静脉注射的MSC[25]。
4,MSC具有主动趋化迁移的特性
MSC的细胞表明表达大量的趋化受体,能敏锐地感受并结合机体里的趋化因子,沿着趋化因子的浓度梯度,从低浓度到高浓度迁移[26]。损伤组织释放的P物质,在体内形成浓度梯度,能吸引MSC沿着浓度梯度迁移到损伤部位进行修复;甚至静脉注射P物质,能动员体内的MSC进入循环并迁移到损伤部位,从而促进损伤组织的修复[27]。心脏心肌有损伤,损伤部位释放趋化因子,可以吸引静脉输入的MSC迁移到损伤部位的心肌组织中,存在可达7天[18]。
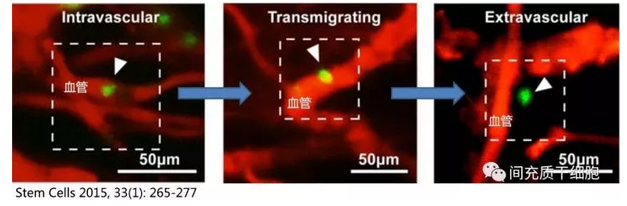
MSC有很强的穿透血管的能力,而且这种能力不受血管通透性的影响,这个在动物实验上得到很好的证明。比如建立皮肤炎症的小鼠模型,给与静脉注射MSC,观察到约47.8%的MSC在2小时后就穿过血管壁进入肌肉组织[28](MSC穿透血管的示意图)。
小结:
不同的实验,MSC在机体内的存在时间存在明显的差异。如果是外周静脉输入,MSC在机体的分布比较一致,先是汇聚在肺部,少部分MSC能通过肺部到达肝、脾、肾、胰腺等血流丰富的器官,极少部分能迁移到骨髓。
从目前的研究结果来看,不管是局部注射还是全身性注射,不管是自体MSC还是异体MSC,机体均会逐渐清除MSC,清除速度与多因素有关,包括机体免疫系统、输入途径、细胞来源的组织、细胞供体的年龄、细胞体外培养时间的长短等。这也提示单次MSC输入治疗的效果并不能持久。
由于MSC具有趋化迁移到损伤部位的特性,因此MSC在健康机体和损伤机体的分布略有差异; MSC无法识别损伤的类型(比如急性损伤或慢性损伤、出血性损伤或缺血性损伤等),如果机体存在多处损伤,那么MSC趋化到每一处损伤部位的细胞数就会减少。
(本文系转载,文章作者和出处(公众号:间充质干细胞;作者东海先生)。)
