靶向FGFR3胞外区域的人scFv抗体的筛选和活性研究
成纤维细胞生长因子(FGF)是最大的一类中胚层和上皮细胞生长分化多肽因子家族。FGFs在许多生物学过程中发挥重要作用,比如胚胎发育,伤口愈合,血细胞生成及血管发生等。此外,已有研究表明FGFs可以增加多种肿瘤细胞的浸润性,如前列腺、膀胱、肾脏、乳房、胰腺等部位肿瘤。
目前,共发现20多种FGFs,对不同类型细胞具有不同的作用。但是,只发现了5种FGF受体(FGFR)。在蛋白水平上,这些受体具有55%-72%的同源性。FGFR结构包括一个胞外配体结合区域,一个跨膜区域以及一个胞内激酶区域。配体结合区域包含三个不同的类似免疫球蛋白结构域(称为免疫球蛋白I,II和III)。FGFR1-3 mRNA的不同的剪接作用形成两种亚型α和β。其中FGFR3具有两种不同的突变体IIIb和IIIc。这两种变体具有不同的亲和活性:IIIc分布更加广泛,能和多种FGFs结合(FGF1,FGF2,FGF4,和FGF9);IIIb优先和FGF1结合,能够较低程度和FGF8和FGF9结合。在有肝素(heparin)作用的情况下,FGFs和FGFRs结合后,FGFs诱导受体二聚化,引起胞内激酶区域的自身磷酸化以及下游信号级联反应的激活。配体受体结合后,FGFs会启动多种信号转导途径:胞内钙离子水平升高,诱导丝裂原活化蛋白激酶和蛋白激酶C通路,激活腺苷酸环化酶以及诱导原癌基因c-myc 和c- fos。
已发现FGFR3会发生特殊突变,导致其酪氨酸激酶活性激活,引起一些与骨骼发育,多发性骨髓瘤,颈部肿瘤以及膀胱肿瘤相关的综合征。最近的研究发现FGFR信号是前列腺肿瘤细胞在体外存活所完全必需的。近来,FGFR3已被作为多发性骨髓瘤的可能治疗性靶点。尽管已有确实证据表明激活的FGFR3突变存在于肿瘤组织中,但是关于FGFR3在肿瘤组织中的表达知道的非常少。近来,使用基因芯片技术对基因表达分析后,发现和正常组织相比FGFR3在膀胱肿瘤样品中过表达。基因表达水平通过Western blot和免疫组化分析在蛋白水平上进一步确证。事实上,这种蛋白的过量产生在过渡性肿瘤中似乎比基因突变更容易发生。所有这些数据都表明FGFR3可能是一个非常有吸引力的泌尿外科肿瘤的治疗性靶点。膀胱肿瘤是生殖泌尿系统第二个最常见的恶性肿瘤之一。大约40%-50%的膀胱肿瘤表现出FGFR3基因发生突变;表皮肿瘤发生的概率(80%)比浸润性肿瘤更大。
随着人们对FGFR3作为不同肿瘤治疗性靶点的兴趣越来越大,以及进来发现它在过渡细胞瘤中的过度表达,我们已开始使用噬菌体展示技术开发用于治疗的人源抗体。噬菌体抗体展示是目前最好的一个开发用于研究,临床以及治疗用途人源抗体的方法。但是,对于抗体开发来说,FGFR3分子非常难以琢磨,因为小鼠和人的FGFR3同源性非常高(92%)。仅最近,有报道通过使用一个库容非常大(2.1*1010)的商业化Fab库,开发出针对一个FGFR3亚型的Fab片段。在我们的试验中,我们使用了两个公开的scFv抗体库Tomlinson I + J (MRCGeneservices, Cambridge, United Kingdom)。两个库的库容都大概在1.4*108。scFvs相比IgG以及Fabs具有更好的肿瘤浸润性,能够更快速被清除,同时具有更好的特异性。在这篇报道中,我们已经筛选出了一些对FGFR3a的亚型IIIc具有特异性的人scFv抗体。这些抗体通过FACS证明可以和膀胱肿瘤细胞系RT112发生反应,并且抑制细胞增殖,具有进一步用于治疗的潜力。
材料和方法
细胞系、蛋白、抗体:
RT112,HEK293;重组人FGFR3a(IIIc)/Fc,FGFR1a(IIIc)/Fc,FGF9,FGF1以及表皮生长因子。鼠抗人FGFR3单克隆抗体,羊抗人IgG(Fc特异性),鼠抗c-myc单克隆抗体,微管蛋白抑制剂;HRP-抗c-myc抗体,抗6His抗体,抗M13抗体,HRP-抗M13单克隆抗体,FITC-兔抗鼠IgG,R-藻红蛋白羊抗鼠IgG,鼠IgG TrueBlot。
FGFR3 cDNA克隆和细胞转染
FGFR3的胞外区域和人IgG的Fc C端融合表达,构建表达载体pcDNA3.1-FGFR3(IIIc)WT-Fc和pcDNA3.1-FGFR3(IIIc)S249C-Fc。然后,转染HEK293T细胞。免疫印迹法和FACS检测蛋白表达和活性。
从噬菌体库筛选FGFR3特异性scFv抗体
人scFv噬菌体库Tomlin-son I + J,辅助噬菌体KM13,E.coli TG1和HB2151。分别单独培养两个噬菌体库,然后1:1混合噬菌体用于筛选。按照示意图1所示,进行噬菌体库筛选和scFv表达。第一轮筛选,使用1ug FGFR3或人IgG蛋白包被微孔板。噬菌体先和人IgG孵育1小时去除可以和Fc发生反应的噬菌体;再和FGFR3包被的孔孵育2小时。最后,微孔板使用0.1%PBST洗涤10遍(下一轮筛选洗涤20遍),使用100ul胰蛋白酶处理微孔板,洗脱结合的噬菌体。洗脱获得的噬菌体按照Goletz等描述的方法进行另一轮的淘选。
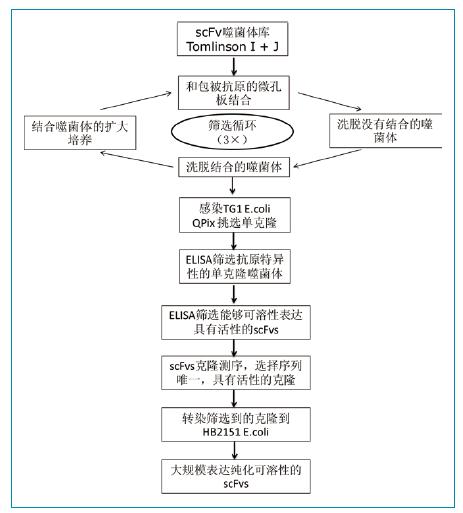
图1:噬菌体库筛选FGFR3特异性scFv抗体流程图
噬菌体ELISA
使用0.3ug的FGFR3,FGFR1或者人IgG蛋白包被微孔板,洗涤,封闭,加入不同浓度前面筛选纯化后的噬菌体悬浮液。孵育后,加入HRP-抗M13抗体,加入底物显色,450nm读取结果。
单克隆噬菌体ELISA
经过两轮或三轮的筛选后收获的噬菌体经过培养生长出克隆,然后使用QPix高通量自动化克隆筛选系统(Molecular Devices)挑取单克隆到含有100ul 2TY培养基的96微孔板,37度培养,第二天使用相同培养基对培养物1:100稀释,然后37度震荡培养2小时,加入25ul含有109辅助噬菌体KM13的2TY培养基,继续培养1小时。菌体经过离心,重悬于2TY培养基,30度过夜培养。最后,离心,取50ul上清,进行单克隆噬菌体ELISA分析。
可溶性scFv抗体的表达纯化和ELISA检测
获得的高特异性克隆,使用E.coli HB2151诱导表达,离心收获菌体,提取细菌周质腔蛋白,最后使用亲和色谱纯化。纯化的各组分使用SDS-PAGE和考马斯亮蓝染色分析。纯化的组分进一步使用分子筛层析分离出scFv蛋白的单体(scFv容易发生二聚体或者多聚体)。
表面等离子体共振分析
使用BiacoreX分析可溶性scFv和FGFR3的结合动力学,并且计算获得每个纯化的scFv的Kd值;使用竞争性结合分析确定每个scFv的特异性结合位点。使用同样的方法分析scFvs和FGF9,FGF1以及EGF是否能竞争结合FGFR3。
流式细胞仪和共聚焦显微镜分析
使用流失细胞仪分析噬菌体scFv和纯化后可溶性scFv在细胞水平上和FGFR3的结合活性。通过处理RT112细胞,然后使用共聚焦显微镜进一步分析抗体结合活性。
细胞增殖分析
使用不同浓度的抗FGFR3 scFvs抗体(0.02-2umol/L)处理RT-112细胞,48小时后,使用MTT对细胞进行染色,然后570nm读数。细胞活力通过下面公式计算:Abs-scFv处理的细胞/Abs-对照组细胞。
结果
筛选FGFR3特异性scFv抗体:如表1所示,总共随机挑选了288个克隆,通过ELISA检测,获得15个FGFR3特异性的抗体克隆。通过测序发现,15个克隆里面有6个克隆的序列是唯一的。3A和1D序列内部有一个终止密码子,只在VL的CDR2区有一个碱基突变。其他4个克隆的序列有比较大的区别,主要区别集中在CDR2和CDR3。其中CDR3在VH和VL都是高度可变的,CDR2的突变主要集中在VH。
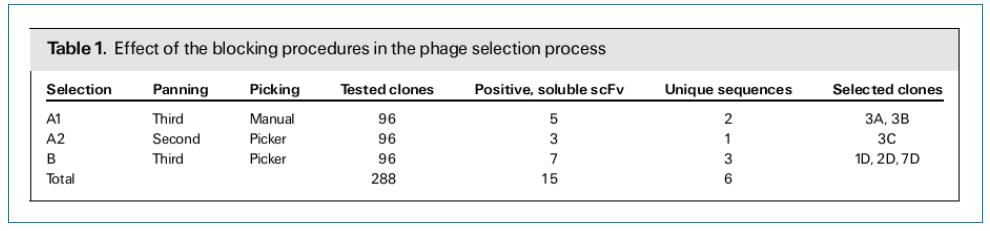
ELISA
地 址: 上海市长宁区福泉北路518号1座501室 联系人: 市场部 电 话: 4008203586 传 真: 021-33721066 Email:info.china@moldev.com
美谷分子仪器(上海)有限公司
商家主页
